Náhrada funkce ledvin
(přesměrováno z Dialýza)
Existuje několik metod náhrady funkce ledvin, z nichž některé lze označit za relativně trvalá řešení a jiná za dočasná. Lze vyčlenit skupinu pacientů, u kterých je třeba zajistit dočasnou náhradu funkce ledvin pro nějaký akutní stav, neboli tam, kde je poškození ledvin reverzibilní. Druhou skupinu tvoří pacienti, jejichž ledviny jsou poškozeny nenávratně (ireverzibilně) a potřebují nahradit funkci ledvin doživotně.
Mezi metody náhrady funkce ledvin patří:
- transplantace ledvin,
- hemodialýza,
- peritoneální dialýza (laváž).
Konkrétní indikace jsou uvedeny u každé metody zvlášť (níže). Obecně platí, že příprava pacienta na náhradu funkce ledviny by měla začít ještě než k selhání ledvin dojde (nejpozději od 4. stadia chronického selhání ledvin), ale mnohdy platí, že čím dříve, tím lépe. Výběr té které metody by měl být přizpůsoben pacientovi – jeho věku (IgA nefropatie postihuje často mladé lidi), prognóze. Jako nejvýhodnější metoda náhrady funkce ledvin se jeví transplantace ledviny, která může být nejen nejefektivnější (návrat ztracené funkce, samostatnost pacienta, prodloužení přežívání...), ale i nejekonomičtější.
Transplantace ledvin
Transplantace ledvin je indikovaná u každého pacienta s chronickým renálním selháním. V současnosti jde o rutinní metodu náhrady funkce ledvin, která by měla být upřednostněna před ostatními (hemodialýza, peritoneální dialýza), a to z hlediska prognostického i ekonomického.
Indikace
K transplantaci by měl být indikován pacient, který dosáhne 4. stadia chronické renální insuficience dle K/DOQI při progresi renálního selhání, obecně platí čím dříve, tím lépe. Ideální by bylo, kdyby před transplantací nemusel pacient podstupovat jinou metodu náhrady funkce ledvin (hemodialýzu).
Onemocnění, která vedou k selhání ledvin:
- glomerulopatie (nejčastěji IgA);
- chronická tubulární onemocnění;
- diabetická nefropatie;
- polycystická choroba ledvin.
V případě diagnózy diabetes mellitus I. typu v kombinaci se závažnou (terminální) diabetickou nefropatií se ledviny transplantují zároveň s pankreatem jako kombinovaná transplantace slinivky a ledvin, kdy se využívá výhod následné společné imunosupresivní léčby. Také již prodělaná transplantace ledvin (s následnou imunosupresivní léčbou) je podpůrným faktorem pro rozhodnutí provést u diabetika transplantaci slinivky.
Kontraindikace
- Akutní nebo chronická infekce;
- srdeční selhání;
- koagulopatie;
- AIDS;
- maligní onemocnění;
- pokročilá onemocnění jater nebo plic.
Dárci
- Živí dárci
Nejčastěji to jsou příbuzní, partneři, ale není to podmínkou. Mohou to být i lidé cizí. Hlavním faktorem je dobrovolnost dárcovství a zdraví dárce. Z důvodu neohrožení dárce odebráním jedné ledviny je nutné výhledově posoudit funkci ledviny, jestli zde nehrozí např. glomerulonefritida?).
- Zemřelí (kadaverózní) dárci
V ČR platí takzvaný předpokládaný souhlas o dárcovství po smrti. Pokud se člověk během života nevyjádří, že orgány darovat nechce, tak se pokládá automaticky za dárce. Jeden z požadavků je mozková smrt prokázaná panangiografie (2x během 30 min), pak také nepoškození funkce ledvin (nutný zachovaný periferní oběh) a studená ischemie až 24 hod.
Imunologie
Kompatibilita v krevních skupinách (AB0 systém) patří k nejdůležitějším. Transplantace je však možná i při neshodě krevních skupin(v ČR od ledna 2011). Protilátky při neshodě musí být z krve příjemce odstraněny např. adsorpcí či plazmaferézou. Pokud dojde ke shodě v co nejvíce znacích HLA a bude zde nízký titr lymfocytotoxických protilátek vyjde nám křížová zkouška negativně. Křížová zkouška se rozumí , že spojíme sérum příjemce, lymfocyty dárce a komplement. Pokud vychází křížová zkouška pozitivní, je potřeba odstranit protilátky.
Chirurgická technika
- Odběr ledviny;
- umístění štěpu heterotopicky do pravé jámy kyčelní (cévy se připojí na iliackou tepnu a žílu, ureter se všije do močového měchýře);
- původní ledviny se většinou ponechají na místě, kde se pozvolna zmenší a atrofují (výjimku tvoří polycystické ledviny, které se odstraňují);
- ve většině případů se transplantuje pouze jedna ledvina, vzácně dvě (druhá do levé jámy kyčelní), když by jedna nestačila k obnovení renální funkce.
Pooperační vývoj
V 65 % případů ledvina funguje ihned po transplantaci. Pacient je hydratován, aby začalo tvoření moči.
V 25 % dochází k opožděnému rozvoji funkce štěpu a ledvina krátkou dobu nefunguje (dny až týdny). Po určité době se funkce rozvine, do té doby je nutná hemodialýza.
V 10% ledvina nefunguje vůbec a to na podkladě trombózy nebo neznámých příčin, ku příkladu kvůli primární afunkci.
Statistická data
Průměrná čekací doba na ledvinu je 12 měsíců, což je mnohem méně než např. v USA (3–4 roky). Je to dáno tím, že spousta pacientů u nás k transplantaci není indikována, i když by být mohla. Až 15 % transplantací ledvin tvoří opakované transplantace. Z důvodu přechozí rejekci štěpu, která není kontraindikací dalšího výkonu. Jednoleté přežívání pacientů po transplantaci přesahuje 95 %. Desetileté přežívání štěpu po transplantaci je 50 %.
Imunosuprese
- Indukční
- ATG – antithymocytární globulin – polyklonální protilátky proti T lymfocytům
- basiliximab – monoklonální protilátka proti IL-2 receptoru na T lymfocytech (anti CD25)
- alemtuzumab (anti CD52)
- Udržovací – trojkombinace:
- kortikoisteroidy (prednison);
- základní imunosupresiva (cyklosporin A nebo tacrolimus);
- adjuvantní imunosupresiva (azathioprin, mykofenolát mofetil).
- Protirejekční – terapie akutní rejekce štěpu:
- pulsní dávky kortikosteroidů 250–500 mg prednisonu po dobu 3–5 dní, pokud nezaberou ani dávky 2–3 g prednisonu, považujeme za kortikorezistentní;
- u kortikorezistence polyklonální antilymfocytární protilátky – ATG nebo monoklonální basiliximab (anti IL-2R), alemtuzumab (anti CD52).
Cyklosporin A a takrolimus se váží na cykloneurin a působí inhibici exprese IL-2.
- Možné nežadoucí účinky
Mezi nežádoucí účinky patří zejména nefrotoxicita a neurotoxicita. Takrolimus může způsobit DM receptorového typu, proto se u diabetiků používá místo takrolimu cyklosporin. Azathioprin je hepatoxický a myelotoxický. Doporučuje se tedy místo něj použít mykofenolát mofetil. V neposlední řadě je nutné zmínit, že mezi další nežádoucí účinky patří i hrozba vzniku DM, Cushingův syndrom, osteoporózu, hyperlipidemii kvůli kortikoidům.
Komplikace po transplantaci
- Časné:
- rejekce štěpu (hyperakutní, akutní) – léčba viz výše;
- močová píštěl;
- trombóza tepny nebo žíly štěpu;
- oportunní infekce:
- CMV pneumonitida (gancyklovir);
- pneumocystóza (cotrimoxazol);
- legionella (erythromycin).
- Pozdní:
- hypertenze (stenóza tepny štěpu);
- chronické jaterní selhání;
- nádory (kůže, lymfomy, Grawitz);
- chronická rejekce.
Hemodialýza
Dialýza je proces, při kterém dochází k odstraňování zplodin látkové přeměny (např. draslíku, močoviny či nadbytečného množství vody) zadržovaných v organismu při selhání ledvin. Využívá se v případě, kdy ledviny nejsou schopny plnit své základní funkce (tj. dialyzační, resorpční a filtrační) ani za klidových podmínek.
Princip dialýzy
Hemodialýza
Zařízení, které umožňuje tento proces, je známé jako umělá ledvina. Toto moderní zařízení je velmi technicky náročné a jsou na něj kladeny vysoké nároky ohledně účinnosti, spolehlivosti, bezpečnosti i jednoduchosti obsluhování. Hemodialýza se provádí většinou v nemocnici nebo ve speciálních dialyzačních střediscích za pomoci všeobecných sester, domácí dialýza není v ČR moc častá, ale za asistence proškoleného člena rodiny se může provádět. Pacient většinou dochází na hemodialýzu cca třikrát do týdne na čtyři až šest hodin. Umělá ledvina je tvořena třemi základními částmi: mimotělní (extrakorporální) oběh krve nemocného, dialyzátor a okruh zajišťující průtok dialyzačního roztoku.
Mimotělní oběh krve
Tato část procesu je prováděna okruhem, který přečerpává žilní krev pacienta za pomoci rotačních pump přes dialyzátor za víceméně stejných hemodynamických podmínek jako v těle nemocného. Vzhledem k tomu, že krev zde přijde do kontaktu s jiným povrchem než je endotel cév, hrozí vznik trombů. Proto je většina pacientů heparinizována (kontraindikováni jsou pouze pacienti s krvácivými stavy). Součástí oběhu jsou také čidla, která kontrolují, aby v krvi nedocházelo ke vzniku vzduchových bublin, které by mohly být zdrojem embolizace.
Dialyzátor
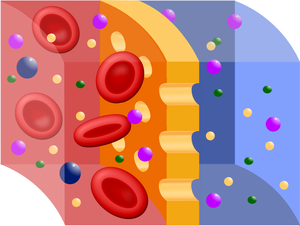
Dialyzátor, neboli kapilára, je hlavní funkční jednotka umělé ledviny. Vlastní dialýza (fyzikálně je to děj, při kterém jsou od sebe oddělovány látky s různou velikostí a rozpustností) a ultrafiltrace látek a vody z krve do dialyzačního roztoku probíhá přes semipermeabilní membránu (viz obrázek). Jako filtry se při prvních pokusech používaly membrány živočišného původu (např. rybí měchýře, střeva), ale nyní se používají hlavně umělé membrány, např. z celofánu, esterů glukózy nebo z některého moderního plastu (Cuprophan), které bohužel mohou mít schopnost stimulovat imunitní systém pacienta (samozřejmě méně než původní materiály) – proto počet dialýz může zvyšovat riziko rejekce transplantátu v budoucnu. Membrána může být v dialyzátoru uspořádána buď ve formě listů, nebo velkého množství tenkých trubiček – cílem samozřejmě je, aby účinná plocha byla co největší. Membrána tak rozděluje dialyzátor na část krevní a dialyzátovou. Po jedné straně membrány krev protéká prouděním laminárním, při čemž se erytrocyty hromadí v ose toku a membrána je tak více omývána plazmou. Objemový průtok zde činí cca 200–300 ml/min. Na opačné straně membrány protéká dialyzační roztok v protisměru a to prouděním turbulentním, objemový průtok je zde cca 500 ml/min. Takto se dosáhne potřebného koncentračního spádu a tím i rychlé difuze toxických nízkomolekulárních látek z krve nemocného do dialyzátu. Dialyzátory bývají většinou na jedno použití, ale u téhož pacienta je možné ho po regeneraci použít vícekrát, k poklesu účinnosti takto nedochází (v současnosti se ale používají kapiláry jednorázové).
Dialyzátový obvod
Tento obvod zahrnuje jak přípravu roztoku, tak jeho průtok dialyzátorem. Dialyzát je připravován smíšením firemně nebo v lékárně připraveného koncentrovaného roztoku hydrogenuhličitanu sodného s upravenou vodou. Je velmi důležité, aby dialyzační roztok obsahoval elektrolyty přibližně ve stejné koncentraci, jaká se nachází v plazmě, a mít správné pH, aby nebyla narušena acidobazická rovnováha pacienta. Zároveň přidáním některých iontů, především K+ a Ca2+, (opět pomocí preformovaných firmou dodávaných roztoků) lze korigovat iontové dysbalance. Do dialyzátu může být přidána glukóza a to paradoxně u pacientů, kteří jsou diabetiky 1. typu, protože u nich hrozí během dialýzy hypoglykémie (vlivem samotné dialyzace, ale i dávkování inzulinu, které je sice pro pacienta normální, ale příjem glukózy je nižší). Během procesu je důležité kontrolovat a udržovat konstantní teplotu. Spotřeba dialyzátů při 4–6 hodinové hemodialýze je asi 150 litrů.
Typy dialýzy
Akutní hemodialýza
Akutní dialýza se používá u náhlých stavů, kde tělo pacienta není samo schopno očistit se od endogenních nebo exogenních toxických látek, objemu tekutiny nebo iontů. Mezi indikace k akutní dialýze patří tyto stavy:
- akutní selhání ledvin – například rychle progredující glomerulonefritida (RPGN),
- hyperkalemie > 6 mmol/l, kterou není možné zvládnout konzervativní terapií,
- hyperkalcemie > 3,5 mmol/l,
- hyperurikemie > 1000 μmol/l,
- nekorigovatelná metabolická acidóza, pH < 7,1,
- hyperhydratace se srdečním selháváním,
- oligourie trvající déle než 3 dny,
- intoxikace nízkomolekulárními látkami rozpustnými ve vodě, které po intoxikaci zůstávají ve volné formě v krevním řečišti – např. ethylenglykol (fridex – nemrznoucí směs), lithium. Další jedy lze eliminovat hemoperfuzí, tj. adsorbcí na aktivní uhlí, která se provádí doplněním hemodialyzačního přístroje o hemoperfuzní patronu (např. jed muchomůrky zelené, paracetamol, některá antidepresiva).
Mezi obecně platné principy akutní dialýzy patři především zvážení, jestli není možné zvládnout některé tyto stavy konzervativní terapií (iontové rozvraty, poruchy vnitřního prostředí), protože dialýza je metoda, která zatěžuje organismus (kardiovaskulární, imunitní systém). U akutní dialýzy se jako vstup používá centrální žilní katetr (CŽK). Frekvence dialýzy dle potřeby.
Chronická hemodialýza
Chronická hemodialýza se používá u pacientů, kteří se obvykle přes chronickou insuficienci ledvin dobrali k renálnímu selhání (stádium 5 dle K/DOQI; zbytková diuréza s GFR<15 mL/min/1.73m^2 nezávisle na hodnotě albuminurie), tudíž stavu, kdy ani při dodržení bazálních podmínek není jejich tělo schopno zbavit se přebytečných metabolitů, objemu tekutin a korigovat vnitřní prostředí (pH, ionty). Pacienti dochází na dialýzu obvykle 3 krát týdně, dialyzují se 4–6 hodin. Z cévních přístupů je preferován arteriovenózní shunt mezi a. radialis a v. cephalica: Pokud je kontraindikován (srdeční selhávání), používá se centrální žilní katetr do v. jugularis. Tato léčba je doživotní nebo do transplantace ledviny.
Indikace k dialýze (u diabetiků dříve)[1]:
- urea > 30 mmol/l,
- kreatinin 600–800 μmol/l,
- clearance kreatininu < 0,25 ml/s.
Onemocnění, která vedou k hemodialýze jsou:
- diabetická nefropatie,
- hypertenzní nefropatie,
- chronické glomerulonefritidy,
- rychle progredující glomerulonefritida (RPGN) – když dosáhne ireverzibilních fibrotických změn,
- autosomálně dominantní polycystická choroba ledvin.
U pacientů, u nichž předpokládáme zahájení dialýzy, bychom měli především kontaktovat Koordinační středisko transplantací, případně kliniku transplantační chirurgie IKEM, abychom zajistili možnost transplantace ledviny v co nejkratším čase. Dále bychom měli léčit anémii (erytropoetinem), kterou trpí většina pacientů s renálním selháním, a provést preventivní očkování proti hepatitidě B (jejíž rozvoj je důvodem odložení transplantace a zkrácení doby přežívání).
Mezi akutní komplikace hemodialýzy patří hypotenze (z náhlé ztráty objemu cirkulující tekutiny), křeče (pokles Na+, K+, Ca2+), arytmie (náhle vzniklá hypokalemie) a krvácení v místě cévního přístupu (souvisí s heparinizací). Mezi chronické komplikace hemodialýzy patří kardiovaskulární komplikace (ICHS, infarkt myokardu, CMP, hypertenze, které jsou u dialyzovaných pacientů častější než u běžné populace), infekce (hepatitida B a hepatitida C), amyloidóza (beta2-mikroglobulin).
Komplikace u chronické dialýzy
- Srdeční selhání
- infekce
- anémie
Peritoneální dialýza
Peritoneální dialýza (PD) je dialyzační metoda náhrady funkce ledvin. PD využívá pobřišnici jako membránu, skrze niž dochází k výměně tekutin a rozpuštěných látek (elektrolytů, urey, glukózy, albuminu, osmoticky aktivních částic a jiných malých molekul) z krve. Dialyzační tekutina se do dutiny břišní přivádí trvale zavedeným katetrem.
Dialýza probíhá buď každou noc během spánku (automatická peritoneální dialýza), nebo během pravidelných výměn během dne (kontinuální ambulantní peritoneální dialýza). PD se využívá jako alternativa hemodialýzy, ačkoli v mnoha zemích (např. USA) výrazně méně často. Je srovnatelně bezpečná, avšak ve většině zemí světa podstatně méně nákladná. Hlavní výhodou PD je možnost podstoupit léčbu bez navštěvování zdravotnického zařízení. Nejčastější komplikací u PD bývá infekce prostřednictvím trvale zavedeného katetru v dutině břišní.
Provedení a typy peritoneální dialýzy
Tekutina se do břišní dutiny dostává peritoneálním katetrem, který je zaveden nastálo přes břišní stěnu pod úrovní pupku. Pacient může dialyzační roztok napouštět a vypouštět do břišní dutiny sám i několikrát denně, a to až 4 krát při kontinuální ambulantní peritoneální dialýze (CAPD), kdy je tekutina v peritoneální dutině ponechána obvykle 6 hodin. Použitý a znečištěný dialyzační roztok se vypouští ven a místo něj se napouští nový a čistý dialyzát (pokud pacient dialyzuje vícekrát denně).
Automatizovaná peritoneální dialýza (APD) pomocí přístroje omezuje počet výměn na jednu denně a nahrazuje časté výměny v noci [2], pacient se připojí před spaním k přístroji zajišťující výměny automaticky a jeho spánek tak není ovlivněn.
- Princip peritoneální dialýzy
Osvědčené postupy
Podle nejlepší doporučené praxe je před zahájením léčby peritoneální dialýzou nutné vyhodnotit, jak dobře pacient chápe samotný proces PD, poučit jej o správné péči o katetr a doplnit veškeré chybějící informace. Pacient by měl být trvale monitorován, aby dialýza probíhala správným způsobem, a měl by být pravidelně vyšetřován kvůli případným komplikacím. Pacient by také měl být řádně poučen o důležitosti prevence infekcí a měl by s ním být sestaven vhodný léčebný plán.[3]
- Při přípravě na zákrok se dutina břišní vyčistí a je chirurgicky zaveden katetr s jedním koncem v dutině břišní a druhým vystupujícím z pokožky.[4]
- Před každou infuzí je nutné katetr vyčistit a ověřit průtok oběma směry.
- Během zhruba deseti až patnácti minut jsou do dutiny břišní zavedeny 2–3 litry dialyzační tekutiny (tzv. dialyzátu). Její celkový objem může dosáhnout až 3 litrů a do tekutiny je možné těsně před podáním přidávat léčiva.
- Tekutina je ponechána v dutině břišní po určitou dobu (tzv. prodleva), kdy do ní z cévního systému skrze pobřišnici přecházejí odpadní produkty. Po uplynutí této prodlevy (v závislosti na léčbě obvykle 4–6 hodin[5]) je tekutina odčerpána a nahrazena čerstvou. To může proběhnout automaticky ve spánku (automatizovaná peritoneální dialýza, APD), nebo během dne, přičemž jsou v břišní dutině neustále ponechávány dva litry dialyzátu a k výměně dochází čtyřikrát až šestkrát za den (kontinuální ambulantní peritoneální dialýza, CAPD).[6][7]
Tekutina obvykle obsahuje sodík, chlorid, laktát nebo bikarbonát a vysoké procento glukózy kvůli zajištění hyperosmolarity.
Intenzita dialýzy závisí na množství dialyzátu, pravidelnosti jeho výměny a koncentraci roztoku. U APD dochází ke 3–10 výměnám za noc, zatímco u CAPD ke čtyřem za den, přičemž objem dialyzátu se pohybuje mezi 2–3 litry a doba prodlevy činí 4–8 hodin.
Viscerální část zaujímá zhruba čtyři pětiny celkové plochy pobřišnice, avšak parietální peritoneum je pro PD důležitější. Princip dialýzy přes membránu vysvětlují dva vzájemně se doplňující modely – model tří pórů (kde molekuly – proteiny, elektrolyty nebo voda – prostupují membránou a ta je „prosívá“ v závislosti na velikosti pórů) a distribuovaný model (který zdůrazňuje úlohu kapilár a schopnosti roztoku zvyšovat počet aktivních kapilár, které se PD účastní).
Vysoká koncentrace glukózy stimuluje osmotickou filtraci tekutiny z peritoneálních kapilár do dutiny břišní. Glukóza poměrně rychle přechází z dialyzátu do krve (kapilár). Po 4–6 h prodlevy obvykle poklesne osmotický gradient glukózy na příliš nízkou úroveň, než aby mohla osmotická filtrace pokračovat. Dialyzát je proto vstřebán zpět z dutiny břišní do kapilár na základě koloidně-osmotického tlaku plazmy, který převyšuje koloidně-osmotický tlak v peritoneu přibližně o 18–20 mmHg (srov. Starlingův mechanismus).[8] Lymfatická absorpce rovněž do určité míry přispívá ke zpětné absorpci tekutiny z dutiny břišní do plazmy. U pacientů s vysokou permeabilitou vody (koeficient UF) peritoneální membrány může ke konci prodlevy docházet ke zvýšené zpětné absorpci tekutiny z peritonea.
Schopnost výměny drobných částic a tekutin mezi peritoneem a plazmou lze klasifikovat jako vysokou (rychlou), nízkou (pomalou), nebo střední. U pacientů s rychlou výměnou dochází k dobré difuzi (snadné výměně malých molekul mezi krví a dialyzátem, určitého zlepšení výsledků lze dosáhnout častějšími, kratšími prodlevami jako při APD), zatímco pacienti s pomalou výměnou vykazují vyšší koeficient filtrace UF (kvůli pomalejší zpětné absorpci glukózy z dutiny břišní, kdy lepší výsledky vykazují delší prodlevy s vyšším objemem tekutiny), ačkoli v praxi lze oba typy pacientů obecně léčit vhodně nastavenou APD nebo CAPD.[9]
Ačkoli existuje několik různých tvarů a velikostí katetrů, které lze použít, různá místa zavedení katetru, počet manžet a uchycení, nejsou známy rozdíly z hlediska morbidity, mortality nebo počtu případů infekce, avšak informace nejsou dostatečně kvalitní, aby bylo možné činit definitivní závěry.[10]
Komplikace
Sleduje se objem odčerpaného dialyzátu a hmotnost pacienta. Zůstává-li více než 500 ml tekutiny nebo ztratí-li se 1 litr tekutiny během tří po sobě jdoucích ošetřeních, bývá upozorněn pacientův ošetřující lékař. Nadměrná ztráta tekutiny může vést k hypovolemickému šoku nebo hypotenzi. Nadměrné zadržování tekutiny může vést k hypertenzi a otokům.
Sleduje se také barva vypouštěné tekutiny: za běžných okolností je v prvních čtyřech cyklech narůžovělá a následně čirá nebo bledě žlutá. Přítomnost růžového nebo krvavého zabarvení ukazuje na krvácení do dutiny břišní, fekálie indikují perforaci střeva a zákal může znamenat infekci.
Pacient může také pociťovat bolest nebo nepohodlí, má-li dialyzát příliš kyselou reakci, je příliš chladný nebo napouštěný příliš rychle. Difúzní bolest a kalná vypouštěná tekutina mohou ukazovat na infekci. Prudká bolest v konečníku nebo perineu může být důsledkem nesprávně zavedeného katetru. Dialyzát může také zvyšovat tlak na bránici a ztěžovat tak dýchání a zácpa může omezovat průtok tekutiny katetrem.[5]
Potenciálně fatální komplikací, která se podle odhadů vyskytuje u zhruba 2,5 % pacientů, je enkapsulující peritoneální skleróza, při níž dochází k zneprůchodnění střev kvůli silné vrstvě fibrinu v peritoneu.[11]
Primárním osmotickým agens v dialyzátu bývá glukóza, což však může vést k zánětu pobřišnice, selhání funkce ledvin a pobřišnice jako membrány a jiným zdravotním komplikacím. K takovýmto problémům může přispívat kyselost, vysoká koncentrace a přítomnost laktátu a zejména produktů rozpadu glukózy v roztoku. Roztoky, které mají neutrální reakci, využívají bikarbonát namísto laktátu a obsahují méně produktů rozpadu glukózy, jsou bezpečnější, avšak zatím neexistují studie, které by to jednoznačně potvrzovaly.[12]
Rizika a výhody
PD je méně efektivní z hlediska odstranění zplodin z těla než hemodialýza a přítomnost katetru představuje riziko peritonitidy možným zanesením bakterií do dutiny břišní.[6] Neexistují dostatečné důkazy o nejlepším způsobu léčby peritonitidy v souvislosti s PD, i když přímé infuze antibiotik do břišní dutiny vykazují nepatrně lepší výsledky než intravenózní podání. Není patrná jednoznačná výhoda jiných často využívaných způsobů léčby, např. pravidelných peritoneálních výplachů nebo užití urokinázy.[13]
Může dojít také k infekci místa zavedení katetru. Počet takových infekcí může snížit profylaxe pomocí nosního mupirocinu, která však nemá vliv na zánět pobřišnice.[14] K infekcím dochází v průměru jednou za 15 měsíců (0,8 epizody na pacienta za rok), na řadě pracovišť však podstatně méně často – jednou za 40 a více měsíců v porovnání s hemodialýzou umožňuje PD pacientovi lepší mobilitu, vzhledem k její průběžné povaze dochází k méně výkyvům ve výskytu symptomů a jsou lépe odstraňovány fosforečnany, ale z těla je odváděno i velké množství albuminu, což vyžaduje neustálé sledování nutričního stavu.
Ve většině zemí světa jsou náklady na PD obecně nižší než na HD, cenový rozdíl je nejvýraznější v rozvinutých zemích.[15]
Neproběhl zatím dostatečně rozsáhlý výzkum, který by porovnal rizika a přínosy CAPD a APD. Nezávislá odborná organizace Cochrane porovnala výsledky tří menších klinických studií a nenalezla žádný rozdíl v klinicky významných parametrech (tj. morbiditě a mortalitě) u pacientů v konečném stadiu onemocnění ledvin, ani výhodu kterékoli metody z hlediska zachování funkčnosti ledvin. Výsledky naznačují, že APD může mít psychosociální výhody u mladších pacientů a těch, kteří jsou zaměstnaní nebo studují.[16]
Mezi další komplikace patří hypotenze (kvůli zvýšené výměně tekutin a úbytku sodíku), bolesti v bedrech a kýly nebo průsak tekutiny kvůli zvýšenému nitrobřišnímu tlaku. PD lze také využívat u pacientů s kardiovaskulární nestabilitou, protože nezpůsobuje rychlé a výrazné změny tělních tekutin a u pacientů s diabetem 1. typu kvůli nemožnosti ovlivňovat hladinu cukru v krvi prostřednictvím katetru. Možnými riziky jsou i hypertriglyceridémie a obezita kvůli velkému množství glukózy v dialyzační tekutině, která může tělu dodávat 2000–5000 kJ denně.[17]
Ze tří typů připojení a systémů výměny tekutin (standardní, se dvěma vaky a se spojkou Y, kde druhé dva jmenované pracují se dvěma vaky a pouze jednou přípojkou ke katetru, přičemž u sady se spojkou Y je jediné propojení tvaru Y mezi vaky pro vypuštění, výplach a napuštění) vykazují systémy se dvěma vaky a spojkou Y lepší výsledky při prevenci zánětu pobřišnice než konvenční systémy.[18]
Rozšíření metody
Podle celosvětového průzkumu z roku 2004 bylo zhruba 11 % pacientů v konečném stádiu onemocnění ledvin léčeno pomocí PD oproti podstatně běžnější hemodialýze. V Hong Kongu a Mexiku je PD běžnější, než je celosvětový průměr – v Mexiku je aplikována u většiny pacientů (75 %) – zatímco v Japonsku a Německu je využití PD pod světovým průměrem.[19]
Improvizovaná dialýza
Peritoneální dialýzu lze provést improvizovaně např. v bojových podmínkách nebo při katastrofách pomocí chirurgických katetrů a dialyzátu vyrobeného z běžně dostupných infuzních roztoků a zajistit tak dočasnou náhradu funkce ledvin u pacientů, u nichž není jiná možnost.
Indikace
Tato metoda je výhodná u mladých pacientů, kteří tak nemusí pravidelně docházet do nemocnice na hemodialýzu, tudíž mohou pokračovat ve svých běžných aktivitách (práce, studium). Dále používáme peritoneální dialýzu u dětí a u oběhově nestabilních pacientů, kde nemůžeme zajistit stálé a vhodné podmínky pro hemodialýzu.
Kontraindikace
Peritoneální dialýzu nelze indikovat u pacientů s rozsáhlými srůsty pobřišnice, kýlou, kolostomií, aktivním střevním onemocněním (Crohnova choroba), ascitem nebo u pacientů nespolupracujících.
Komplikace
Nejčastější komplikací je vznik infekce – obvykle stafylokoková peritonitida zanesená katetrem (ATB terapie celková i lokální). Časem může vlivem peritoneální dialýzy dojít ke ztluštění peritonea. Tím je porušena jeho difuzní funkce a pacient by měl být převeden na hemodialýzu.
Odkazy
Související články
- Chronické onemocnění ledvin
- Akutní selhání ledvin
- Cévní přístupy pro dialýzu
- Katétr pro peritoneální dialýzu
- Dialyzační amyloidóza
Externí odkazy
- Česká transplantační společnost pacientům - transplantace ledvin
- Koordinační středisko transplantací - transplantace ledvin
Zdroj
- PASTOR, Jan. Langenbeck's medical web page [online]. [cit. 24.5.2010]. <http://langenbeck.webs.com>.
Reference
- ↑ ČEŠKA, Richard, et al. Interna. 1. vydání. Praha : Triton, 2010. 855 s. s. 558. ISBN 978-80-7387-423-0.
- ↑ ČEŠKA, Richard, et al. Interna. 2. vydání. Praha : Triton, 2015. 909 s. ISBN 978-80-7387-895-5.
- ↑ Wood, M; et al. (2008-08-01). "Nephrology Nursing Standards and Practice Recommendations" (PDF). Canadian Association of Nephrology Nurses and Technologists. Retrieved 2010-09-08.
- ↑ Haralampos V. Harissis et al. A new simplified one port laparoscopic technique of peritoneal dialysis catheter placement with intra-abdominal fixation. The American Journal of Surgery 192 (2006) 125–129 https://www.youtube.com/watch?v=0MuJURb7vpg
- ↑ a b Best practices: evidence-based nursing procedures. 2007. ISBN 1-58255-532-X.
- ↑ a b Crowley, LV (2009). An Introduction to Human Disease: Pathology and Pathophysiology Correlations. Jones & Bartlett Publishers. pp. 507–509. ISBN 0-7637-6591-0.
- ↑ McPhee, SJ; Tierney LM; Papadakis MA (2007). Current medical diagnosis and treatment. McGraw-Hill. pp. 934–935. ISBN 0-07-147247-9.
- ↑ Rippe, B, Venturoli, D, Simonsen, O, de Arteaga, J (2004). "Fluid and electrolyte transport across the peritoneal membrane during CAPD according to the three-pore model.". Perit Dial Int 24: 10–27. PMID 15104333.
- ↑ Daugirdas, JT; Blake PG; Ing TS (2006). "Physiology of Peritoneal Dialysis". Handbook of dialysis. Lippincott Williams & Wilkins. p. 323.
- ↑ Strippoli, GFM; Tong A; Johnson DW; Schena FP; Craig JC (2004). Strippoli, Giovanni FM, ed. "Catheter type, placement and insertion techniques for preventing peritonitis in peritoneal dialysis patients". Cochrane Database of Systematic Reviews 4: CD004680.doi:10.1002/14651858.CD004680.pub2. PMID 15495125.
- ↑ Kawanishi, H.; Moriishi, M. (2007). "Encapsulating peritoneal sclerosis: prevention and treatment". Peritoneal dialysis international : journal of the International Society for Peritoneal Dialysis. 27 Suppl 2: S289–S292. PMID 17556321.
- ↑ Perl, J.; Nessim, S. J.; Bargman, J. M. (2011). "The biocompatibility of neutral pH, low-GDP peritoneal dialysis solutions: Benefit at bench, bedside, or both?". Kidney International 79 (8): 814–824. doi:10.1038/ki.2010.515. PMID 21248712.
- ↑ Ballinger, AE; Palmer, SC; Wiggins, KJ; Craig, JC; Johnson, DW; Cross, NB; Strippoli, GFM (26 April 2014). "What is the best treatment to manage peritonitis in people on peritoneal dialysis?". Cochrane Database of Systematic Reviews 4: CD005284.doi:10.1002/14651858.CD005284.pub3. PMID 18254075.
- ↑ Strippoli, GFM; Tong A; Johnson DW; Schena FP; Craig JC (2004). Strippoli, Giovanni FM, ed. "Antimicrobial agents for preventing peritonitis in peritoneal dialysis patients". Cochrane Database of Systematic Reviews 4 (4): CD004679. doi:10.1002/14651858.CD004679.pub2.PMID 15495124.
- ↑ Karopadi, AN; Mason G; Rettore E; Ronco C (2013). Zoccali, Carmine, ed. "Cost of peritoneal dialysis and haemodialysis across the world". Nephrol Dial Transplant 28: 2553–69. doi:10.1093/ndt/gft214. PMID 23737482.
- ↑ Rabindranath, KS; et al. (2007). Rabindranath, Kannaiyan S, ed. "Continuous ambulatory peritoneal dialysis versus automated peritoneal dialysis for end-stage renal disease". Cochrane Database of Systematic Reviews 2 (2): CD006515. doi:10.1002/14651858.CD006515.PMID 17443624.
- ↑ Ehrman, JK; Gordon P; Visich PS; Keteyian SJ (2008). Clinical Exercise Physiology. Human Kinetics. pp. 268–269. ISBN 0-7360-6565-2.
- ↑ Daly, C; Khan, I; Rabindranath, KS; Vale, L; Wallace, SA (13 August 2014). "Y-set and double bag systems offer the most protection against peritonitis during continuous ambulatory peritoneal dialysis (CAPD)". Cochrane Database of Systematic Reviews (8): CD003078.doi:10.1002/14651858.CD003078.pub2. PMID 11406068.
- ↑ Grassmann, A; Gioberge S; Moeller S; Brown G (2005). "ESRD patients in 2004: global overview of patient numbers, treatment modalities and associated trends". Nephrology Dialysis Transplantation 20 (12): 2587–2593. doi:10.1093/ndt/gfi159. PMID 16204281.
Použitá literatura
- ČEŠKA, Richard, et al. Interna. 1. vydání. Praha : Triton, 2010. 855 s. ISBN 978-80-7387-423-0.
- BENEŠ, Jiří, Pravoslav STRÁNSKÝ a František VÍTEK. Základy lékařské biofyziky. 2. vydání. Praha : Karolinum, 2007. 201 s. ISBN 978-80-246-1386-4.
- HRAZDIRA, Ivo a Vojtěch MORNSTEJN. Lékařská biofyzika a přístrojová technika. 1. vydání. Brno : Neptun, 2001. ISBN 80-902896-1-4.